赤ちゃんの段階で背骨が発生する際、「脊索」という原始的な構造が最初に形成されます。この脊索は発達過程で退縮していくものですが、時折この脊索が頭蓋底部に遺残してしまうことがあります。これが脊索腫のもとになると言われています。背骨の元になる脊索は正中に存在する構造であり、このため脊索腫も基本的に正中部に発生します。臨床的に悪性の転機を辿る腫瘍であり、局所再発傾向が非常に強い一方で、中には転移や播種を来すものも存在します。手術単独での完治も条件が揃えば可能ですが、放射線を加えた集学的治療が必要となるケースも多いです。
より専門的な知識をご希望の方は、私が執筆した文献(頭蓋底脊索腫:専門医が知っておくべき最新知識. 脳神経外科速報. 28:1108-1117, 2018)もご参考になれば幸いです。
脊索腫は非常に稀な腫瘍で、罹患率は10万人対0.08人程度と見積もられています(Chambers KJ et al. Laryngoscope. 124:1097-1102, 2014)。このため、治療経験が豊富な施設が限られているのが現状です。ただでさえ再発が多い腫瘍ですので、中途半端な治療では再発を繰り返すことになります。
仙骨部を始め、背骨に発生することもある腫瘍ですが、本ページでは頭蓋底部に発生するものに焦点を絞って解説致します。
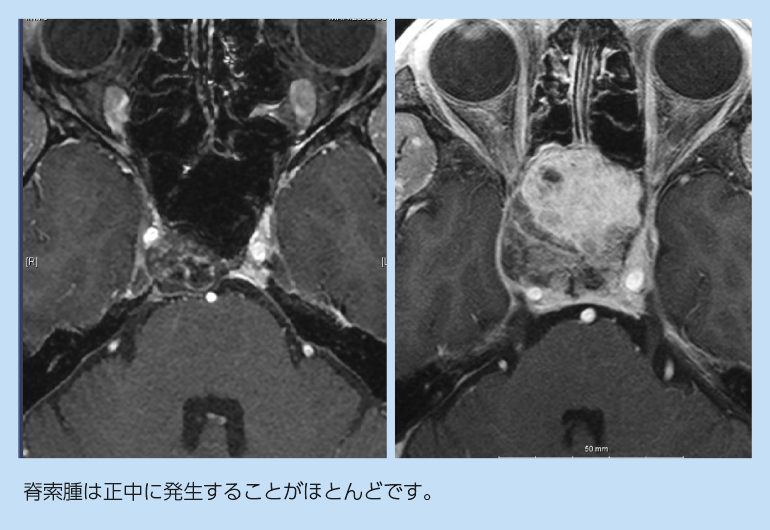
頭蓋底脊索腫の症状
脊索腫に特徴とされる症状はありませんが、斜台部に好発するため、最も近い外転神経(眼球を外側へ動かす神経)の障害で気付かれることが多いです。これは複視、つまり「物が二重に見える」という症状になります。腫瘍の進展方向によっては、上方すなわち海綿静脈洞内進展を来せば動眼神経(眼球を上下内側に動かす・開眼させる)、三叉神経(顔の感覚、嚙むための筋肉を司る)、更に上方へ進展すれば視神経に影響が出ます。またもう少し足側を中心に発生した場合、大きくなるまで気付かれにくく、鼻閉感で発症することもあります。頚静脈孔・舌下神経管を圧迫することで喉回りの症状(声がれ、飲み込みの障害、舌の運動障害)も出現します。頭と首の間の位置(頭蓋頚椎移行部といいます)で発生した場合には、骨・関節の破壊に伴い首の痛みを生じることもあります。また脳幹を圧迫するような場合にはバランスの障害、歩行障害なども加わります。
頭蓋底脊索腫の診断
CT・MRIで可能です。造影剤で染まることもあれば染まらないこともあります。T2強調画像という撮像法では高信号となります。また拡散強調画像という撮像で高信号となることがあります。時折血流に富む脊索腫を見かけますが、この場合には血管撮影という方法で腫瘍への栄養動脈が描出されることもあります。
頭蓋底部の真ん中に位置する斜台という場所に腫瘤を形成することが多く、特に前方に伸びて蝶形骨洞を充満するような進展形式が多いように思います。脊索腫以外に斜台正中部を主座とする腫瘍が少ないことから、診断に苦慮することは少ないと思います。最も留意すべきは頭蓋底軟骨肉腫との鑑別ですが、軟骨肉腫は比較的外側に発生することが多く、正中病変であれば脊索腫の可能性が高くなります(ただし正中発生する軟骨肉腫もあります:軟骨肉腫のページ参照)。脊索腫と軟骨肉腫は、再発傾向が大きく異なり、従って治療戦略が異なりますので、病理検査でしっかり鑑別しておくことが肝要となります。その他、副鼻腔原発の癌、線維性骨異型性症、斜台部血管腫、頭蓋底浸潤性の下垂体腺腫等が鑑別に挙がります。
頭蓋底脊索腫の治療
手術切除が治療の核となります。
経鼻内視鏡手術
頭蓋底脊索腫はほぼ確実に頭蓋底正中部に腫瘍の中心が存在しますので、経鼻内視鏡手術(拡大経蝶形骨洞法)の良い適応となります。
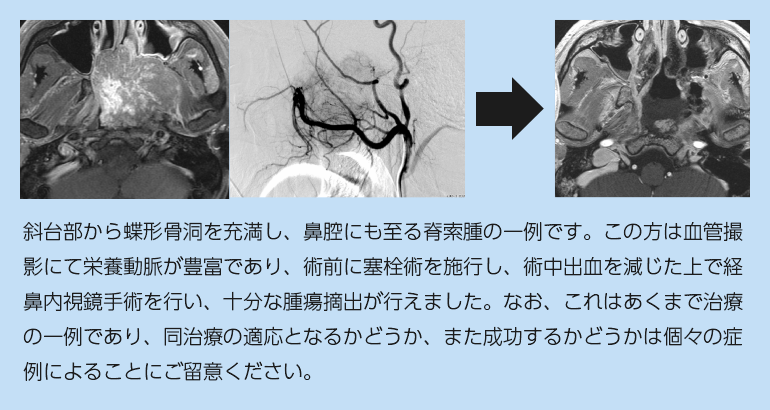
アプローチの基本は下垂体腺腫に対するものと同様ですが、より外側・頭尾方向に展開する必要があるため、篩骨洞という副鼻腔を部分的に削除したり、蝶形骨洞の開放範囲を拡大する必要があります。一方で中鼻甲介や下鼻甲介を切除する必要はほとんどありません。但し脊索腫は鼻腔内に進展することもままあるため、その場合には脊索腫が接していた周辺構造は出来る限り切除する必要があります。
頭蓋底軟骨肉腫と同列に扱われることが多い疾患ですが、手術の原則は大きく異なります。まず脊索腫では、周囲骨組織に浸潤し、それらの取り残しが高率に再発の原因となります。このため、安全に可能な限り、腫瘍を超えた範囲で摘出を行うべきと考えています。具体的には、腫瘍実質を摘出した後に、腫瘍が接していた骨などを1-2mm程度除去します。また、摘出時にこぼれ落ちた細胞も再発の原因となることがあり(播種といいます)、摘出に先立って鼻腔の壁をシート状の綿で保護したり、なるべく腫瘍がばら撒かれないように注意して手術道具を出し入れたりする必要があります。
前述の通り、時には非常に血管に富むものがあり、画像所見によっては血管内治療による術前塞栓も検討されます。
手術後の方針
腫瘍の全摘出が達成出来れば、経過観察のみで経過を追っていくことになります。特に周囲軟部組織の郭清まで達成できた場合、再発の可能性は高くありませんが、それでもゼロとは言えないため、MRIで3か月~半年ごとに経過観察していくことになります。
安全性・侵襲性の観点から亜全摘で留まった場合、再発を予防すべく計画的に放射線治療をお勧めすることになります。
放射線治療
脊索腫は基本的には放射線に耐性と考えられており、通常の分割照射(=一回線量が低い)では効果が低いと考えられています。このため、一回線量を高く設定できるガンマナイフや、brag peakを利用できる陽子線・重粒子線が用いられます。
重粒子線や陽子線では5 年制御率が50 〜75 %程度と報告されています。但し、かなりの高線量照射となるため、有害事象(側頭葉脳壊死、脳神経障害、粘膜・骨壊死など)を認めることも比較的多いとされています。他方、ガンマナイフでは5 年制御率は60 %程度とされていますが、比較的放射線障害のリスクが小さいこと、単回照射で治療できること、身近で簡便に行えることが利点となります。特に私共のグループは、脊索腫に対する拡大ガンマナイフ照射を積極的に行っており、5年腫瘍制御率73%と既存照射方法に比べて好成績を得られることが分かってきました(Int J Radiat Oncol Biol Phys. 2022. doi: 10.1016/j.ijrobp.2022.02.024. Online ahead of print.)。
抗腫瘍薬治療(かなり専門的な話になりますので、ご興味がある方のみご覧ください)
脊索腫に絶対有効と言える薬剤はまだ見つかっていませんが、世界的には研究成果が蓄積されてきています。特に、多くの癌腫で癌化に大きく影響しているとされる受容体型チロシンキナーゼの変異が脊索腫でも見つかっており、実際にチロシンキナーゼ阻害剤にする研究的治療も行われてきています。下記に現在考えられている標的分子と研究治療の概況をお示しします。
なお、これらは本邦では脊索腫に保険適応が通っていない治療がほとんどであることをご留意ください。
- EGFR(上皮成長因子受容体):多くの癌腫と関係が深いとされている受容体チロシンキナーゼの一種です。HER1とも呼ばれます。正常ではRAS-MAPK経路、PI3K-AKT経路を介して細胞増殖・細胞生存に関わっているとされています。脊索腫ではこのEGFRが過剰活性化を受けていることが多く、EGFRを標的とした臨床試験が実際に行われています。EGFRを標的とする薬剤としては、EGFRのチロシンキナーゼ阻害剤として選択的EGFR阻害作用を持つエルロチニブ、EGFRおよびHER2の阻害作用を持つラパチニブが挙げられ、またEGFRのリガンド結合部位自体に結合して作用を阻害するセツキシマブもあります。
- PDGFR(血小板由来成長因子受容体):こちらも多くの癌腫との関連が示唆されている受容体チロシンキナーゼの一種です。下流にはRAS-MAPK経路、PI3K-AKT経路、およびPLCを介するシグナル伝達経路が知られています。PDGFRにはαとβが存在しますが、脊索腫は特にPDGFRβの過剰活性化が起きているとされています。非選択型PDGFRおよびc-kit、 BCR-ABLチロシンキナーゼ阻害剤であるイマチニブ、より強力な阻害作用かつSRCファミリーキナーゼにも阻害効果を有するダサチニブが挙げられます。
- mTOR:受容体チロシンキナーゼのシグナル経路の一つであるPI3K-AKT経路の下流に位置する分子で、細胞生存・細胞増殖に関わっています。またVEGF、PDGF等の転写を促進させる作用を持つHIF-1αの発現を増大させ、血管新生を促進することで低酸素条件下での腫瘍生存を可能にします。阻害剤としてはエベロリムスが挙げられます。イマチニブと同時投与での治験が報告されています。
- 多標的阻害剤:特定のチロシンキナーゼではなく、複数の標的分子のチロシンキナーゼを阻害する作用を持った薬を指します。VEGFR、PDGFR、c-Raf、BRAF、c-kit等に阻害効果を有するソラフェニブ、 VEGFR、PDGFR、kit、グリア細胞由来神経栄養因子受容体(RET)、マクロファージコロニー刺激因子受容体(CSF-1R)等に阻害効果を有するスニチニブ、VEGFR、PDGFR、FGFR、c-Kit、CSF-1R等に阻害効果を有するパゾパニブが挙げられます。
- Brachyury:病理検査において脊索腫のマーカーともされる。 BrachyuryはT-box遺伝子(T遺伝子)によりコードされる転写因子で、発生段階で脊索に特異的に高発現しています。東京大学脳神経外科の研究において、Brachyury 発現が高い群でPI3K-AKT経路の活性化が強く、再発傾向が強かったという報告がなされています。Brachyury はほとんどの正常組織に発現していないため、標的とすれば腫瘍特異的な治療になり得ると期待されています。現在Brachyuryワクチンを用いた第二相臨床研究が進行中です。
- SMARCB1(別名INI-1):所謂エピジェネティクス(クロマチン構造の修飾による遺伝子発現制御)に関連する因子です。DNAは通常、ヒストンという蛋白質に巻き付いてヌクレオソームを形成し、それが数珠のように連なって核内に存在します(クロマチン構造と呼びます)。このクロマチン構造が緩むことにより転写が促進され、反対に凝集されることによって転写が抑制されます(これらをクロマチンリモデリングと呼びます)。BAF(BRG1 associated factors)複合体はこのクロマチンリモデリングを行う蛋白質複合体の一つで、このサブユニットの一つがINI-1です。INI-1が欠失するとポリコーム複合体2(PRC2)の中でEZH2が過剰発現し、これがヒストンH3蛋白の27番目のリジン残基(H3K27)をメチル化することで、標的遺伝子の発現が抑制されてしまいます。このEZH2の阻害剤としてタゼメトスタットがあり、EZH2を選択的に阻害することで癌抑制遺伝子の発現抑制を阻害し抗腫瘍効果を発揮します。
- CDKN2A(別名p16):細胞周期を回し細胞増殖を促すCDK4・CDK6を抑制する癌抑制蛋白質であり、多くの癌腫で変異が報告されています。パルボシクリブはこのCDK4・CDK6の阻害剤であり、現在治験が進行中です。
遺伝子パネル検査に基づく治療
腫瘍がどのような遺伝子変異を実際に持っているかは患者ごとに異なります。遺伝子パネル検査では数百種類の癌連遺伝子変異の有無を病理検体から網羅的に解析し、抗癌剤の選択に役立てることを目的とします。遺伝子パネル検査の結果によっては、分子標的薬が治療候補として挙がってくる可能性があり、また現在承認されている薬がなくても、治験中の薬や、適応外の薬があるかもしれず、将来適応可能となる薬剤が見つかるかもしれません。治療介入可能な変異が見つかる可能性はそこまで高くはないのが現状ですが、標準治療を尽くしても制御不能な場合には考慮され得る手法の一つと考えています。

